Гидрирование
Гидри́рование (гидрогениза́ция) — химическая реакция, включающая присоединение водорода к органическому веществу. В ходе данной реакции молекула водорода присоединяется к двойной или тройной связи молекулы. Если в результате гидрирования происходит разрыв связи углерод — углерод или углерод — гетероатом, то такой процесс называется гидрогенолизом.
Гидрирование широко применяется для получения органических веществ как в лаборатории, так и в промышленном масштабе. Оно также используется в некоторых процессах очистки, например, для удаления следов ацетилена из этилена или примесей кислорода из различных систем.
История
Первая описанная в литературе реакция каталитического гидрирования была проведена в 1874 году. Она заключалась в превращении ацетилена и этилена в этан. Расцвет каталитического гидрирования был связан с работами Поля Сабатье, который превратил гидрирование в универсальный метод и в 1912 году получил за это Нобелевскую премию. В оригинальной работе водород и пары органического вещества пропускали над медным или никелевым катализатором при температурах 100—300 °C. В данное время такой метод гидрирования не используется.
Механизм
Гидрирование находится в равновесии с обратным процессом дегидрирования и является сильно экзотермическим процессом (105—125 кДж на 1 моль водорода). Согласно принципу Ле Шателье, такое равновесие должно смещаться вправо при понижении температуры, поэтому в промышленных реакциях иногда ограничивают температуру, повышающуюся из-за экзотермичности реакции.
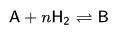
Гетерогенный катализ
За небольшими исключениями, молекулярный водород не реагирует с органическими веществами при температуре ниже 480 °С. Реакция с газообразным водородом возможна лишь на поверхности катализатора, который сорбирует и водород, и органические молекулы, облегчая их контакт. Однако даже в таких условиях энергия активации реакции составляет 6,5—16 ккал/моль (значения измерены для реакции пропилена с водородом в присутствии различных катализаторов). Активность металлических катализаторов в данной реакции уменьшается в следующем ряду:
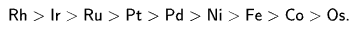
Из металлов данного ряда сейчас используются только платина, палладий, родий, рутений и никель. Также находят применение и некоторые другие вещества.
Согласно механизму Хориути — Поляни (1934), реакция на поверхности катализатора осуществляется постадийно. На первой стадии происходит сорбция субстрата и водорода на катализаторе, затем на второй стадии атом водорода мигрирует к β-углеродному атому двойной связи и образуется связь между металлом и α-углеродным атомом. Наконец, на третьей стадии происходит восстановительное элиминирование продукта. Между присоединением первого и второго атома водорода проходит некоторое время, за которое могут происходить водородный обмен, цис-транс-изомеризация или миграция двойной связи. Побочные процессы также ускоряются при недостаточном насыщении катализатора водородом. Гидрирование протекает тем быстрее, чем менее затруднена молекула. Скорость гидрирования алкенов уменьшается при увеличении числа заместителей при двойной связи. Электронные эффекты гораздо меньше влияют на реакцию.
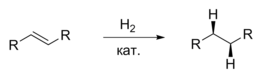
Считается, что атомы водорода, находящиеся на поверхности катализатора, присоединяются к молекуле субстрата с одной стороны, из-за чего образуются продукты цис-конфигурации.
Гомогенный катализ
При гомогенном катализе водород и гидрируемое вещество координируются внутри каталитического комплекса. При этом водород диссоциирует, за счёт чего и происходит его активация. Активация водорода может происходить тремя способами, из которых лишь третий важен для рассмотрения механизма гомогенного катализа реакции гидрирования:
- путём окислительного присоединения;
- путём гомолиза;
- путём гетеролиза.
Активация алкена происходит также за счёт координации с атомом металла. При этом алкены никогда не вытесняют из комплекса другие лиганды, поэтому их координация может происходить только к ненасыщенным комплексам, которые должны образовываться в реакционной смеси. Способность алкена связываться с металлом во многом зависит от доступности его двойной связи и её конфигурации. Образующиеся алкеновые комплексы переходных металлов не очень активно активируют молекулярный водород, поэтому большинство известных каталитических систем реагируют по дигидридному каталитическому циклу. (Описаны также алкеновый и алкильный цикл, однако они встречаются редко.) Типичным примером такого поведения служит катализатор Уилкинсона, который реагирует с водородом, образовывая дигидридный комплекс. Далее происходит координация с алкеном, его миграция и восстановительное элиминирование продукта, после чего ключевой каталитический интермедиат вовлекается в очередной цикл реакции.
Лимитирующей стадией является атака алкена на дигидридный комплекс. Недиссоциированные комплексы родия с этиленом не могут активировать кислород, поэтому этилен отравляет катализатор в своей собственной реакции восстановления и является нежелательной примесью при гомогенном восстановлении других алкенов.
Несмотря на то, что присоединение атомов водорода происходит не одновременно, стереохимический результат можно описать как син-присоединение (то есть с образованием цис-продуктов). Причина такой стереоселективности в том, что родий и водород присоединяются к двум углеродным атомам двойной связи синхронно. Второй атом водорода внедряется по связи углерод — родий, сохраняя общую цис-конфигурацию. Показано также, что водород преимущественно присоединяется с более доступной стороны двойной связи, что затем было использовано при дизайне хиральных катализаторов гомогенного гидрирования.
Гомогенный катализ дигидридного типа имеет ряд преимуществ перед гетерогенным катализом и гомогенным катализом других типов. Короткое время жизни алкильного комплекса уменьшает вероятность реакций изомеризации. Это свойство также позволяет проводить реакции дейтерирования.
Условия реакции
Каталитическое гидрирование развилось в два основных направления: гидрирование в стеклянном приборе при низких температурах (до 100 °C) и низком давлении (1—4 атм) и гидрирование при высоком давлении (от нескольких до нескольких сотен атм) и температурах от 20 до 400 °С. Второй метод гидрирования требует более сложных приборов — автоклавов, выдерживающих давление до 350 атм. В лабораторных условиях гидрирование под высоким давлением проводят в небольших стальных цилиндрах, присоединённых к источнику водорода и насосу, перемешивание в которых осуществляется при помощи магнитной мешалки, а нагревание — на масляной бане.
Субстраты
Гидрирование может применяться для соединений различных классов. Используемые субстраты и соответствующие им продукты приведены в таблице.
| Субстрат | Формула субстрата | Продукт | Формула продукта |
|---|---|---|---|
| алкены | R2C=CR2 | алканы | R2CH-CHR2 |
| алкины | RC≡CR | алкены | цис-RCH=CHR |
| альдегиды | RCHO | первичные спирты | RCH2OH |
| кетоны | RCOR' | вторичные спирты | RR’CHOH |
| карбоновые кислоты | RCOOH | первичные спирты | RCH2OH |
| сложные эфиры | RCOOR' | два спирта | RCH2OH, R’OH |
| имины | R2C=NR' | амины | R2CH-NHR' |
| амиды | RC(O)NR'2 | амины | RCH2NR'2 |
| нитрилы | RCN | имины | RCH=NH |
| нитросоединения | RNO2 | амины | RNH2 |
| сульфиды | RSR' | насыщенные соединения | RH, R’H, H2S |
Катализаторы
Для проведения реакции гидрирования используют широкий набор катализаторов. Достаточно активными являются металлы группы платины: платина, палладий, родий и рутений. В качестве экономичных альтернатив предложены недрагоценные металлы: никель (Алюминат никеля(II)), медь, молибден и кобальт. Данные металлы обладают способностью сорбировать одновременно субстрат и водород, облегчая реакцию между ними.
Катализаторы гидрирования делятся на две группы:
- гетерогенные катализаторы, являющиеся твёрдыми веществами и образующие отдельную фазу в жидкой реакционной смеси;
- гомогенные катализаторы, растворяющиеся в жидкой среде.
Гетерогенные катализаторы
Платиновые катализаторы
Первоначально предложенные виды платины (коллоидная платина, платиновая губка) вышли из употребления: на смену им пришли катализаторы с более воспроизводимыми свойствами. Оксид платины PtO2 (катализатор Адамса) представляет собой стабильный коричневый порошок, который под действием водорода превращается в платину с очень высокой активностью. Он подходит почти для всех реакций гидрирования, активируется некоторыми солями металлов, дезактивируется серой и другими каталитическими ядами, выдерживает сильные органические и минеральные кислоты.
Для увеличения площади контакта катализатора с водородом и гидрируемыми веществами платину осаждают на специальные подложки (активированный уголь, силикагель, сульфат бария и другие). Это достигается путём восстановления платинохлористоводородной кислоты в водных суспензиях данных материалов. Такие катализаторы содержат 5, 10 или 30 % платины по массе, имеют высокую активность, часто проявляют пирофорность.
Платиновые катализаторы могут служить для гидрирования разнообразных веществ при комнатной температуре и невысоком давлении (1—4 атм), но они неэффективны при восстановлении карбоновых кислот или сложных эфиров до спиртов.
Палладиевые катализаторы
Палладиевые катализаторы весьма похожи на платиновые. Оксид палладия PdO получают из хлорида палладия и нитрата натрия. Металлический палладий получается при восстановлении хлорида палладия боргидридом натрия. Палладиевые катализаторы на подложках (угле, карбонате кальция, сульфате бария) содержат 5 или 10 % палладия. Катализаторы на основе палладия более часто модифицируют для получения заданной селективности. Например, палладий на карбонате кальция, дезактивированный ацетатом свинца, служит для частичного гидрирования алкинов до цис-алкенов (катализатор Линдлара).
Палладиевые катализаторы можно использовать в сильнокислой и щелочной среде. Они подходят для гидрогенолиза защитных групп бензильного типа.
Никелевые катализаторы
Катализаторы на основе никеля универсальны и используются как в лаборатории, так и в промышленности. В качестве носителя используется кизельгур, в водной суспензии которого осаждают карбонат никеля (действием карбоната натрия на нитрат никеля), который затем восстанавливают водородом при 450 °C, после чего сушат при 110—120 °С.
Весьма активными являются катализаторы типа никеля Ренея: их получают из сплава никеля и алюминия путём растворения в 25—50 % растворе гидроксида натрия при нагревании. Алюминий растворяется, а никель остаётся в виде очень мелкого порошка. В зависимости от условий образуется катализатор той или иной активности. Никель Ренея может использоваться для восстановления практически любых функциональных групп, он не дезактивируется серой и может быть использован для десульфурирования серосодержащих соединений. Катализаторы P-1 и P-2, похожие по активности на никель Ренея, получают восстановлением солей никеля, например, ацетата никеля, боргидридом натрия. Они содержат большую долю борида никеля, не пирофорны и могут применяться для гидрирования при комнатной температуре и атмосферном давлении. Никель, осаждённый из раствора хлорида никеля алюминиевой или цинковой пылью, называется катализатором Урушибары и по активности также похож на никель Ренея.
Другие гетерогенные катализаторы
В реакциях гидрирования применяются также катализаторы на основе оксидов меди, цинка и хрома, однако их использование ограниченно, поскольку они требуют высоких температур (150—200° C) и давления (100—150 атм). То же самое касается рениевых катализаторов.
Гомогенные катализаторы
Отдельный класс катализаторов гидрирования составляют соединения, растворимые в органических растворителях, — катализаторы гомогенного гидрирования. Они представляют собой комплексы благородных металлов. Наиболее известным примером является хлорид трис(трифенилфосфин)родия. Гомогенное гидрирование обычно проводят при комнатной температуре и атмосферном давлении. Оно менее эффективно и более селективно, чем гетерогенное гидрирование, поэтому больше подходит для восстановления сложных полифункциональных субстратов. Также данные катализаторы применяются в энантиоселективном гидрировании, поскольку предоставляют большие возможности для введения хиральных лигандов.
В промышленности такие катализаторы используются только в тех случаях, когда не удалось подобрать подходящий гетерогенный катализатор. Это связано тем, что их трудно выделить из реакционной смеси. Тем не менее, хиральный катализатор на основе родия используется в промышленном синтезе леводопы.
Активность катализаторов
На активность катализаторов большое влияние оказывает присутствие посторонних примесей, которые могут увеличить, уменьшить скорость гидрирования или даже полностью его остановить. Например, всего 0,2 % примеси палладия на платиновом катализаторе с угольной подложкой деактивирует этот катализатор в реакции гидрогенолиза бензильных защитных групп и галогенов.
Самыми сильными ингибиторами благородных металлов являются сера и большинство серосодержащих соединений. За исключением отдельных случаев (например, использования катализатора Линдлара) их присутствие в реакционной смеси весьма нежелательно. Удаление их из среды можно провести под действием никеля Ренея, который связывает серу в виде сульфида никеля. Встряхивание или перемешивание реакционной смеси с этим катализатором делает возможным дальнейшее гидрирование в присутствии благородных металлов. Многие нуклеофилы (меркаптаны, сульфиды, цианиды, иодиды) выступают как ингибиторы по отношению к платине, палладию и родию.
Большую роль играет также кислотность среды: для гидрирования ароматических колец необходимо наличие кислоты, а реакции с участием никеля Ренея обычно проводят в присутствии третичных аминов или щелочей.
Другие условия
Каталитическое гидрирование проводят в присутствии 1—3 % платинового катализатора (в расчёте на массу металла). Никель Ренея используется в гораздо бо́льших количествах. Лучшие растворители для водорода (пентан, гексан) не всегда являются таковыми для остальных компонентов реакции. Растворяющая способность метанола и этанола по отношению к водороду в три раза ниже, однако они используются наиболее часто. Также в качестве растворителей для проведения гидрирования используют бензол, циклогексан, диоксан и уксусную кислоту. Вода также может быть использована для гидрирования тех веществ, которые в ней растворимы (например, кислот и их солей).
На скорость реакции влияет температура, хоть это влияние не так сильно, как в случае других реакций. Повышение давления ожидаемо увеличивает скорость гидрирования. Поскольку реакция является трёхфазной, эффективным перемешиванием также не следует пренебрегать.
Проведение реакции
Для проведения реакции необходимо рассчитать количество водорода, которое необходимо затратить на гидрирование субстрата. Особенно это важно для реакций частичного гидрирования, когда требуется вовремя остановить реакцию. В точных расчётах необходимо учитывать давление пара растворителя, поскольку оно также вносит вклад в общее давление в системе. Если в качестве катализатора используются оксиды металлов, необходимо также учесть количество водорода, необходимое для их восстановления.
При смешивании реагентов следует аккуратно обращаться с пирофорными катализаторами: обычно раствор добавляют к катализатору, находящемуся в реакционном сосуде, а не наоборот.
Выделение продукта проводят фильтрованием катализатора и упариванием растворителя. Перегонка или перекристаллизация обычно приводят к чистому продукту. Если используется гомогенный катализатор, то обработка реакционной смеси более сложная и зависит от типа катализатора.
Применение
Наиболее важными примерами гидрирования в промышленности являются синтез Фишера — Тропша (гидрирование оксида углерода(II) для получения метанола и углеводородов), гидрирование угля, использовавшееся во времена Второй мировой войны для получения жидкого топлива, а также гидрирование азота с образованием аммиака (процесс Габера — Боша).
